Définition
Les alliages binaires sont des composés formés de métal et d’un second élément qui peut être un autre métal ou un autre élément tel que le carbone (Fer+Carbone par exemple). On parle souvent d d’alliage fer et carbone. Ces alliages binaires permettent d’obtenir les caractéristiques que les matériaux purs ne permettent pas. On avait déjà traité un cours intitulé Débuter la métallurgie:
Microstructure et refroidissement des métaux purs
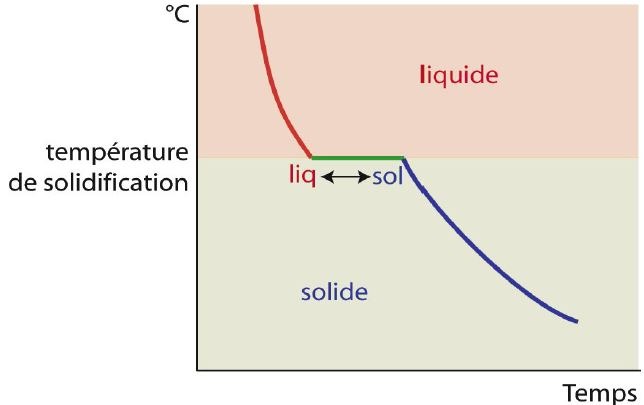
La micrographie ne montre qu’un seul type de grains. Lorsqu’un métal pur en fusion est refroidi, le changement de phase s’effectue toujours à une température fixe : le point de fusion. Au point de fusion, les deux phases liquide et solide co-existent. La détermination de ce point s’effectue en enregistrant la courbe de refroidissement (température en fonction du temps). Un palier isotherme est d’autant plus marqué que le refroidissement est lent et que la masse du métal est grande.

Structure micrographique du Cuivre (photo Struers)
Alliages homogènes de solutions solides
Les solutions solides se dissolvent l’un dans l’autre. C’est le cas par exemple du Bismuth (Bi) et de l’Antimoine (Sb). Ils sont totalement solubles l’un dans l’autre quelque soit le pourcentage de l’un par rapport à l’autre. On se retrouve avec un alliage binaire homogène à une seule phase.
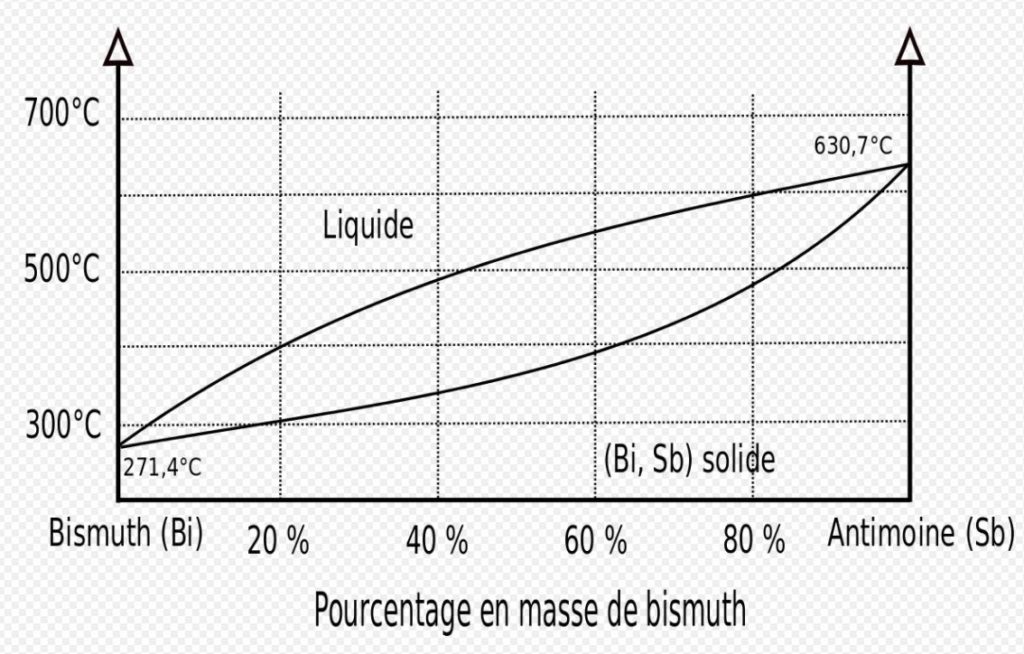
Alliages homogènes combinaisons chimiquement définies (CCD)
Ce sont des combinaisons de deux éléments. Ils sont représentés par une formule chimique. C’est le cas de la cémentite par exemple, Fe3C. On les retrouve dans le diagramme Fer – Carbone.
Alliages hétérogènes
Ce sont alliages présentant différentes phases. Ces phases peuvent être celles des métaux purs, des solutions solides et/ou des combinaisons chimiquement définies.
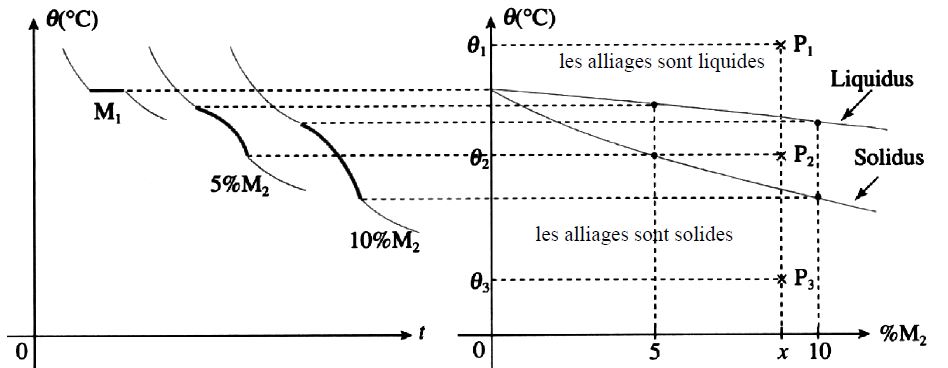
Différentes courbes de refroidissement des alliages binaires
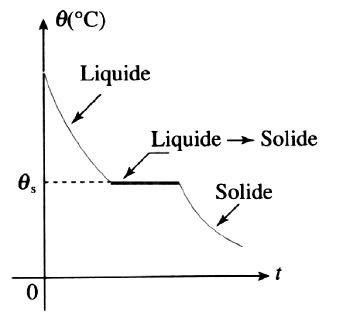
1er cas: solidification à température constante
La température reste la même pendant la durée de la solidification. C’est le cas des métaux purs, des combinaisons chimiquement définies et du cas particulier des alliages hétérogènes présentant un point eutectique.(voir ultérieurement dans le diagramme fer carbone par exemple).
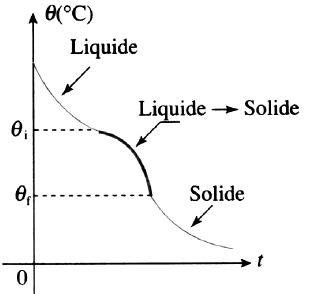
2ème cas: solidification à température variable
Le premier cristal du au refroidissement apparait lorsque la température atteint la température θi. La dernière goutte de liquide et donc la cristallisation totale apparait lorsqu’on atteint la température θf. Cette situation se rencontre pour les solutions solides.
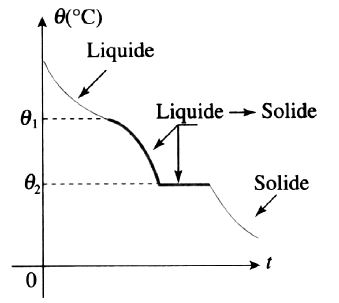
3ème cas: solidification en deux parties
Dans le cas des alliages hétérogènes, on a la superposition des deux courbes précédentes.
Construction des diagrammes alliages binaires à solution solide unique
Les alliages binaires sont composés de deux éléments . Selon leur pourcentage de l’un et par déduction de l’autre, les températures de solidification sont différentes. Sur les schémas suivants on aura donc une courbe de solidification qui se construit en fonction du pourcentage de masse de l’élément d’alliage. On part donc du métal pur (0% de M2) pour 100% de M1. Les températures de début de solidification et de fin de solidification ne sont pas les mêmes en fonction du pourcentage d’alliage. Les deux courbes construites (début et fin de solidification) se nomment Liquidus et Solidus.
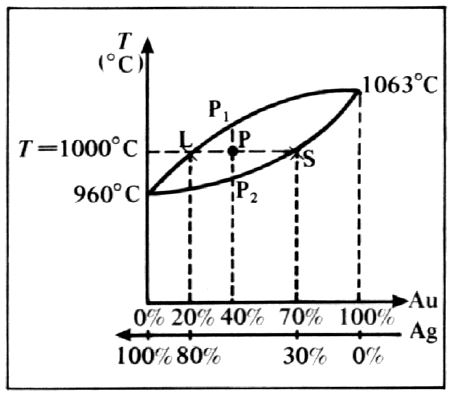
Exemple du diagramme à solution unique Or Argent
Cet exemple très clair permet de comprendre le fonctionnement des diagrammes à solutions uniques:
L’alliage représenté par le point P est composé de 40% d’Or(Au) et de 60% d’Argent(Ag).
On peut lire que si on a un mélange de 20% d’Or et 80% d’Argent, notre point de début de solidification se fera à 1000°C (point L). On constate aussi qu’a 1000°C, c’est la fin de solidification si notre alliage était composé de 70% d’Or et de 30% d’Argent.
La règle des segments inverses ou bras de levier dans cet exemple montre qu’à 1000°C on a PS/LS=30/50=60% de liquide et LP/LS=20/50=40% de solide.
Construction des diagrammes alliages binaires à deux solutions solides
Exemple du diagramme Fer Cémentite
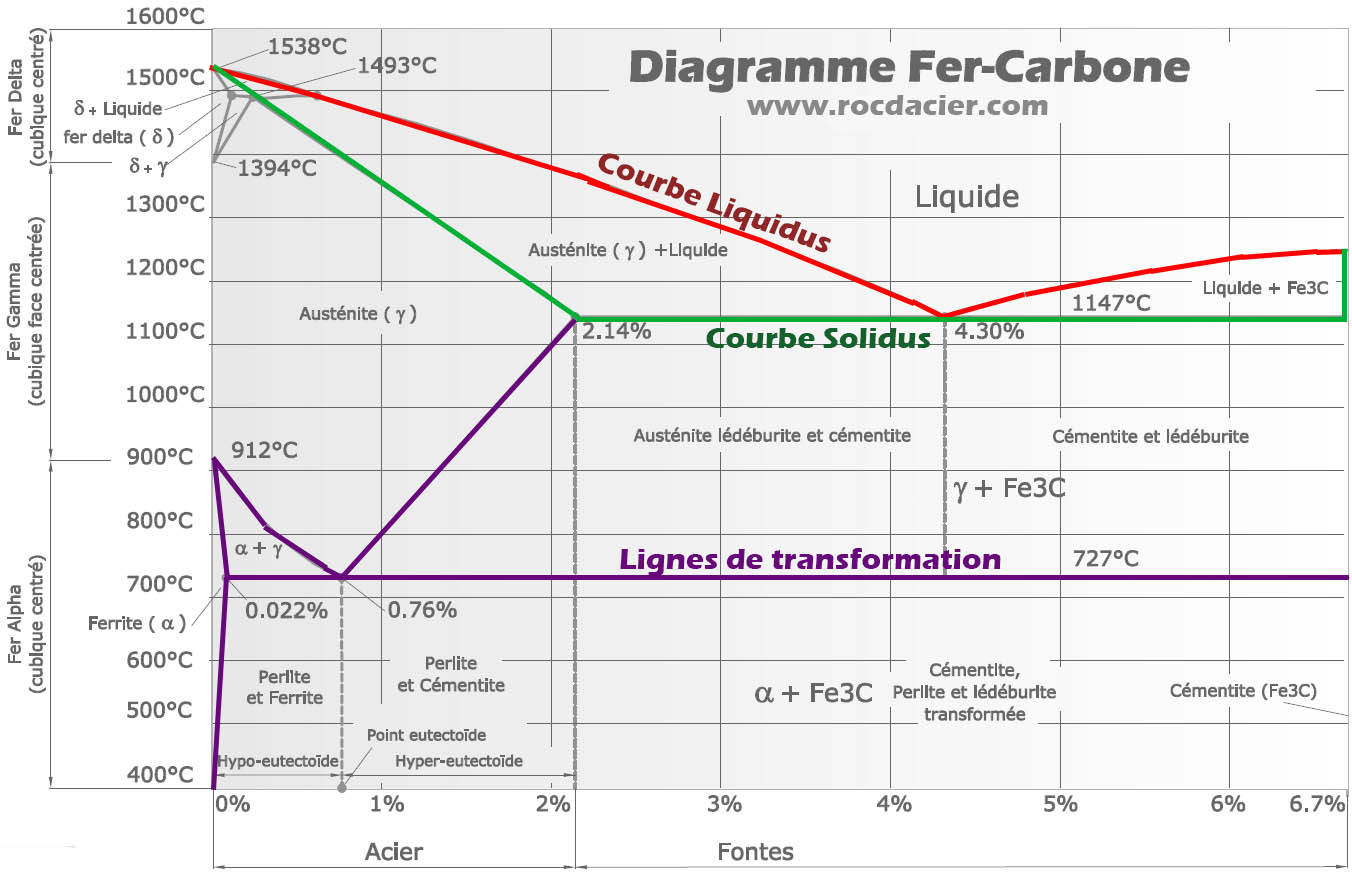
Le diagramme Fer Cémentite correspond aux aciers et aux fontes blanches. Il est caractérisé par la présence de cémentite Fe3C. On l’appelle aussi diagramme de phase fer carbone.
Les lignes du diagramme fer carbone
L’acier non allié, cependant appelé alliage de fer et de carbone est représenté par ce digramme de phase:
Les points particuliers du diagramme
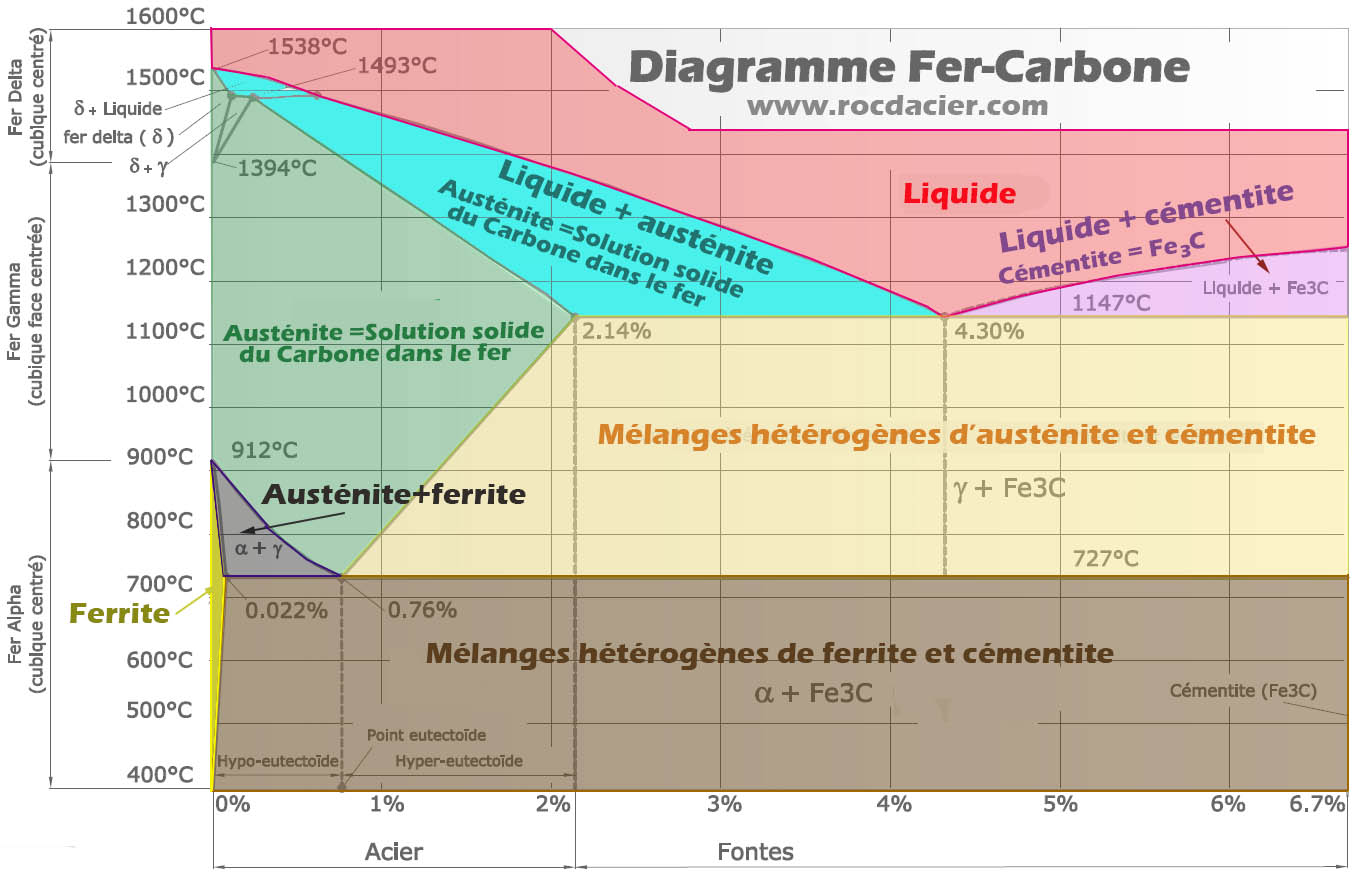
Domaines et phases importantes du diagramme
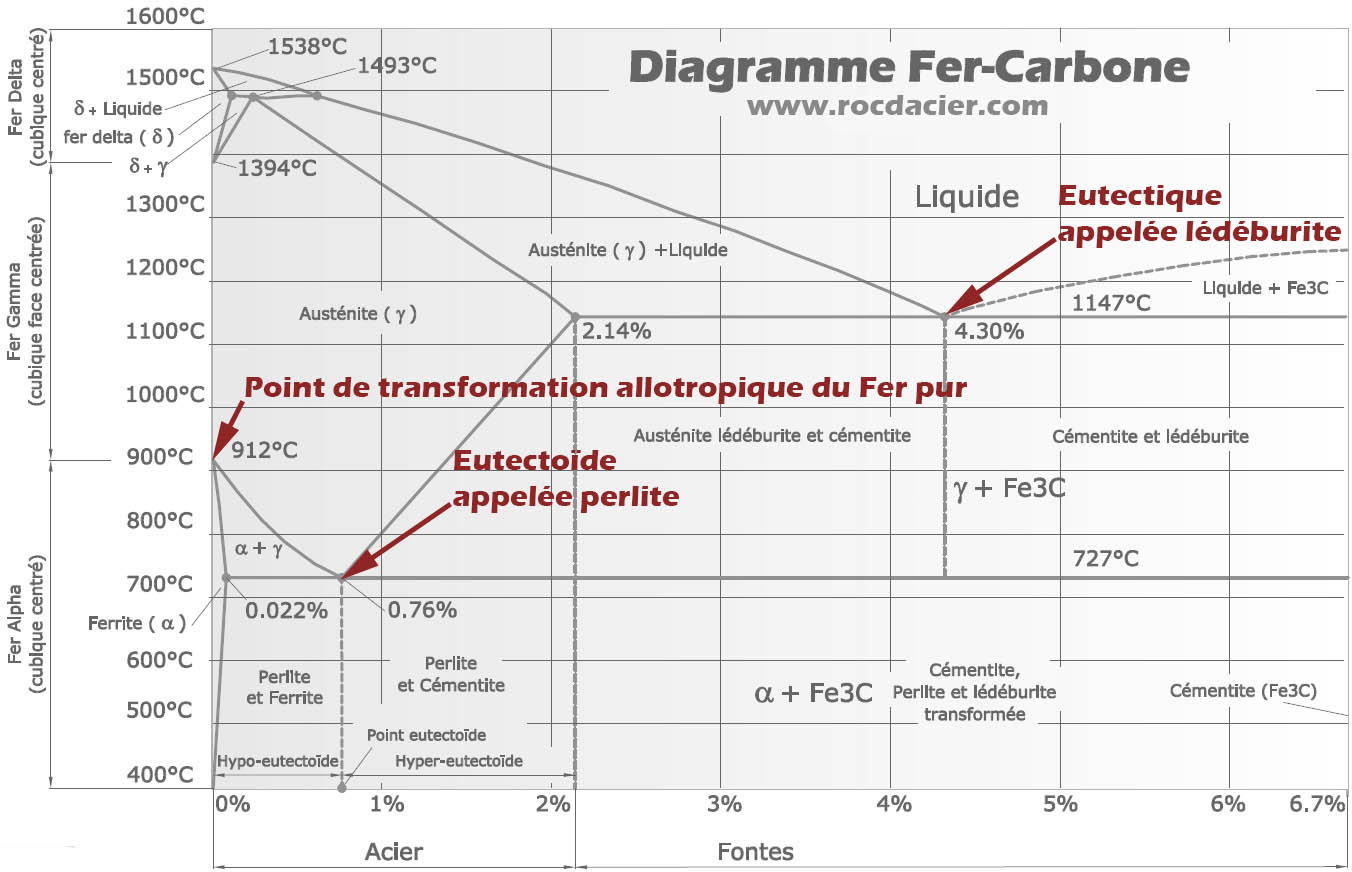
Nota:
– La ferrite est une solution solide de carbone dans le fer (α)
– La lédéburite (eutectique)à 1145°C est un mélange des deux phases d’austénite et de cémentite (domaine beige)
– La perlite (eutectoïde)à 721°C est un mélange des deux phases de ferrite et de cémentite (domaine maron)
– C < 0,85%: aciers hypoeutectoïdes, constitués de ferrite et de perlite;
– C = 0,85%: acier eutectoïde, constitué de perlite;
– C > 0,85%: aciers hypereutectoïdes, constitués de cémentite et de perlite.
Ressources:
Wikipédia, Cours de STI2D de Claude Divoux, Livres Terminale génie mécanique, Dossier métallurgie BTS de M.BENTI, précis de métallurgie.
Produits Rocdacier
Quelques produits sont en vente sur le site : livres, posters, vêtements ignifugés, stickers…