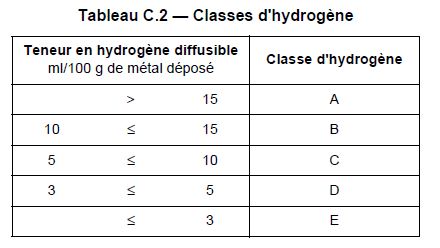
On utilise ce terme en métallurgie surtout avec l’hydrogène qui, s’il ne se diffuse pas suffisamment dans la ZF, risque de créer de la fissuration à froid.
Chaque matériau possède une limite de solubilité qui est le seuil à partir duquel le MB arrive à saturation d’hydrogène (peut s’estimer selon le Ceq chez les acier). Ce dernier ne peut plus se diffuser (il est à saturation) et crée alors des bulles qui se transformeront en soufflures à la solidification. Plus la limite de solubilité est faible, moins le MB pourra absorber d’hydrogène, plus il sera sensible à ces soufflures.
L’analogie du parking
Je vous propose une analogie. Le MB a un certain nombre de places de parking par unité de volume, disons 100 par milligramme, c’est sa limite de solubilité (il y aura donc 1000 places de parking pour 10 milligrammes de MB). Chaque atome d’hydrogène est une voiture.
Lorsqu’il y a moins de voitures que de places de parking, les voitures peuvent toutes se garer dans les places de parking, autrement dit tous les atomes d’hydrogène peuvent se diffuser dans le MB.
Le problème intervient lorsqu’il y a trop de voitures. Une fois toutes les voitures garées, il n’y a plus de places de parking disponibles : il est à saturation. Les voitures qui ne peuvent se garer tentent alors de se garer n’importe où et forment les bulles. Ces bulles sont les soufflures, et la suite vous la connaissez.
L’objectif à dégazer l’hydrogène, dans le cas de la fissuration à froid, est donc de diminuer le nombre de voitures présentes sous le seuil des 100 places de parking par milligramme.
Pour revenir sur l’hydrogène
A noter qu’on ne parviendra jamais à éradiquer l’hydrogène (y-compris dans le métal d’apport qui ne peut être débarrassé de tout hydrogène lors de sa fabrication). Néanmoins, tant qu’on ne dépasse pas cette limite de solubilité, l’hydrogène n’aura aucun impact.
La limite de solubilité évolue en fonction de :
- La température du matériau (de façon simpliste, plus c’est chaud, plus c’est soluble. En réalité, voir les diagrammes de solubilité).
- Les éléments d’addition et de leur teneur (susceptibles d’augmenter ou de diminuer la solubilité).
- L’action combinée de plusieurs éléments d’addition (deux éléments d’addition peuvent avoir plus d’impact sur la solubilité que la somme de leurs effets individuels).
L’illustration de la buée dans la salle de bain
Une bonne illustration est votre salle de bain.
L’air contient constamment de l’eau, c’est « l’hygrométrie ». Ainsi, une hygrométrie à 70% signifie que l’air est à 70% de saturation d’eau, 100% étant naturellement la limite de solubilité, le seuil où l’eau commence à former des gouttes (l’équivalent liquide des bulles formées par l’hydrogène).
Lorsque vous prenez votre douche chaude, la température de la pièce augmente. Une partie de l’eau de la douche se solubilise dans l’air ambiant, le reste est l’eau qui coule sur vous.
Cet air chaud et saturé d’eau emplit la pièce et atteint les murs en carrelage, les miroirs et les vitres. Or ces surfaces mettent plus de temps que l’air à modifier leur température (ils sont plus isolants). Lorsque l’air chaud et humide touche ces surfaces froides, l’air chaud se refroidit très localement. Conséquence directe, la limite de solubilité de cet air refroidi diminue, et l’eau en excès redevient liquide. C’est cette dernière que vous observez sur ces surfaces.
La solubilité du Carbone dans le Fer
En pratique, la solubilité est plus complexe. Dans le cas du Carbone dans le Fer, prenons un regard simple sur le diagramme Fer-Carbone.
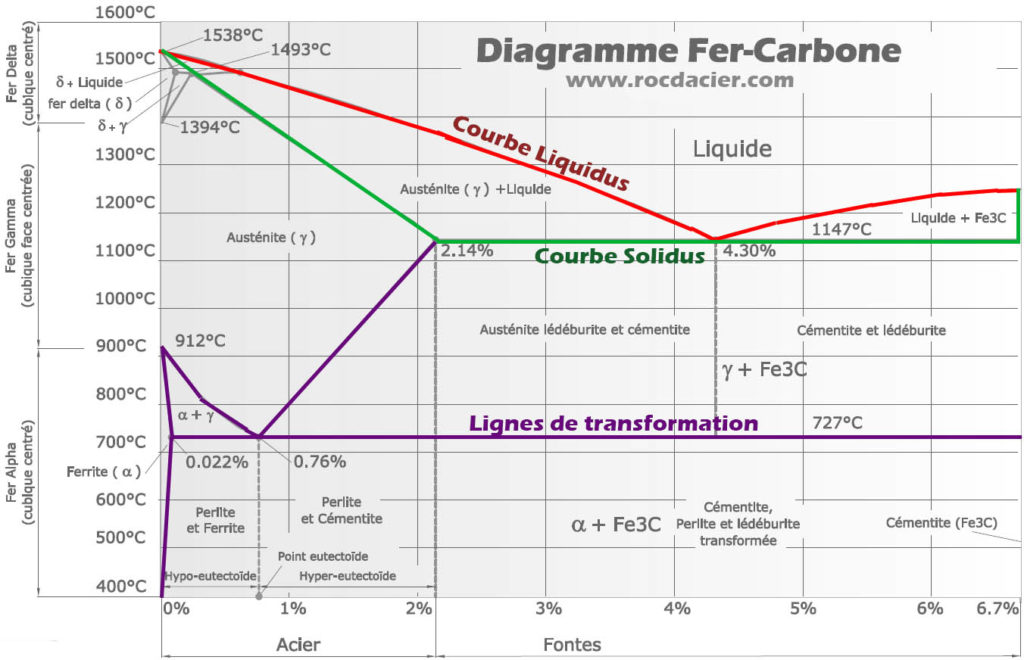
En quelques mots :
- La solubilité maximale du Carbone dans la Ferrite α est de 0,022% de Carbone en masse à 727°C.
- La solubilité maximale du Carbone dans le Fer γ (l’austénite) se situe à 1147°C et est de 2,14% de la masse totale composée de Carbone.
- C’est pour ces raisons que l’excédant de Carbone va former d’autres composés avec le Fer au refroidissement (ou au réchauffage au-delà de la température-seuil), de la même façon que de l’eau liquide apparaît lorsque l’air refroidit.
Concentrons-nous sur le point eutectoïde à 0.76% de Carbone pour l’étudier de façon très simpliste :
- 0.76% de Carbone en masse dans le Fer est la répartition exacte de la Perlite (composée pour rappel de Ferrite α + Cémentite). A 0.76%C, nous avons donc 100% de Perlite dans notre matériau.
- En-dessous, pas assez de Carbone pour nourrir la Perlite, on a d’autant plus de Ferrite α que le taux de Carbone est faible, le reste étant de la Perlite.
- Au-dessus, on a un excès de Carbone, d’où présence de Cémentite aux joints de grains (qui s’insère où elle peut), en quantité d’autant plus importante qu’il y a de Carbone.
L’explication est simpliste car il faut en plus tenir compte de la structure cristalline de chaque phase (CC ou CFC pour α et γ) qui a la place d’accueillir plus ou moins d’atomes de Carbone, et ont donc des limites de solubilité différentes…
Produits Rocdacier
Quelques produits sont en vente sur le site : livres, posters, vêtements ignifugés, stickers…